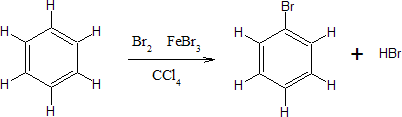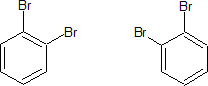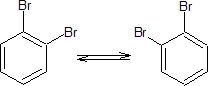ESTRUCTURA DEL BEBCENO
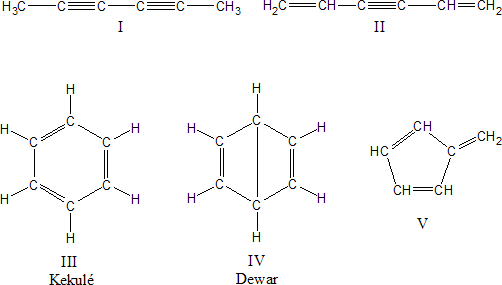
Como ya señalamos se conocía su fórmula molecular (C6H6), pero el problema estaba en conocer como se disponían los átomos en la estructura. En 1858 Kekulé propuso que los átomos de carbono se podían unir entre sí para formar cadenas. Posteriormente en 1865 propuso para poder resolver el problema del benceno, que estas cadenas carbonadas a veces se pueden cerrar formando anillos. Para representar la estructura del benceno se habían propuesto las siguientes:
Todos estos intentos de representar la estructura del benceno representaban las distintas formas en que se trataba de reflejar la inercia química del benceno. Recientemente Van Temelen sintetizó el benceno de Dewar "biciclo (2,2,0) hexadieno", sustancia que sufre una rápida isomerización de enlace de valencia para dar benceno.
Un análisis de las características químicas del benceno permite ir descartando estas posibles estructuras. Así, el benceno sólo da un producto monobromado:
Es decir, se sustituye un hidrógeno por un bromo y se mantienen los tres dobles enlaces. Esto implica que los hidrógenos deben ser equivalentes, ya que el reemplazo de cualquiera de ellos da el mismo producto, por lo tanto podemos descartar las estructuras I, II y V propuestas.
Asimismo el benceno reacciona nuevamente con el halógeno para dar tres derivados disustituidos isómeros de fórmula molecular C
6H
4X
2 ó C
6H
4XZ. Este comportamiento esta de acuerdo con la estructura III.
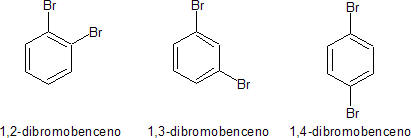
Esta estructura III a su vez permitiría dos isómeros 1,2-dihalogenado, que serían:
pero realmente sólo se conoce uno. Kekulé sugirió incorrectamente que existe un equilibrio rápido que convierte un isómero en el otro, en el caso del derivado dibromado
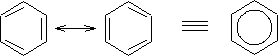
Para poder comprenderlo, hay que tener en cuenta que la estructura de Kekulé de dobles enlaces, los enlaces sencillos serían más largos que los dobles enlaces. Sin embargo, esto no es así, ya que experimentalmente se ha comprobado que los enlaces carbono-carbono en el benceno son todos iguales (1,397 A) y que el anillo es plano. Entonces lo que sucede con las estructuras de Kekulé, las cuales solo difieren en la ubicación de los enlaces p, es que el benceno realmente es un híbrido de resonancia entre estas dos estructuras:
de tal manera que los electrones p están deslocalizados a lo largo de la estructura, y por tanto el orden de enlace carbono-carbono es aproximadamente 1.1/2 . De acuerdo con esto los enlaces carbono-carbono son más cortos que los enlaces sencillos pero más largos que los dobles enlaces.
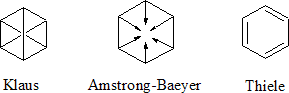
Por todo ello la estructura real del benceno no es ninguna de las de Kekulé sino la del híbrido de resonancia que se representa con un hexágono con un círculo, lo que sucede es que para una mejor comprensión del comportamiento y para poder explicar algunos mecanismos de reacción, haremos uso de las estructuras de Kekulé.
Este planteamiento de resonancia por deslocalización permite explicar la mayoría de los propiedades del benceno y sus derivados en función de la estructura. De acuerdo con lo dicho, el benceno consiste en un anillo donde los seis átomos de carbono presentan una hibridación
sp2, uniéndose a dos átomos de carbono adyacente y a un átomo de hidrógeno. De esta manera los enlaces carbono-carbono son todos iguales y los ángulos de enlace son exactamente de 120º.
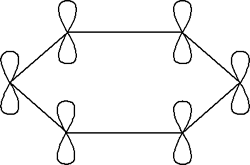
Como consecuencia y tal como se ve en la segunda figura cada átomo de carbono tendría un orbital
p sin hibridar que sería perpendicular al plano que forma el anillo de carbonos en donde se alojaría un electrón. Estos seis electrones que según la estructura de Kekulé serían los que darían lugar a los tres dobles enlaces (enlace p) realmente lo que hacen es deslocalizarse a lo largo de todo el anillo, por lo cual se representa el benceno mediante un hexágono con un círculo inscrito, en lugar de los tres dobles enlaces localizados.
Con esto lo que se pretende es recordar que de hecho no hay tres enlaces sencillos ni tres dobles enlaces, ya que como hemos dicho los enlace son iguales, y de esa manera evitar que se puedan representar isómeros supuestamente diferentes y que sólo se diferencien en la colocación de los dobles enlaces, ya que se suele recurrir a las estructuras de Kekulé para representar mecanismos e indicar el desplazamiento de pares de electrones individuales.