LEY DE LOS GASES IDEALES
En condiciones normales y en condiciones estándar, la mayoría de los gases presentan comportamiento de gases ideales.
Si se reduce la presión sobre un globo, éste se expande, es decir aumenta su volumen, siendo ésta la razón por la que los globos meteorológicos se expanden a medida que se elevan en la atmósfera. Por otro lado, cuando un volumen de un gas se comprime, la presión del gas aumenta. El químico Robert Boyle (1627 - 1697) fue el primero en investigar la relación entre la presión de un gas y su volumen.
La ley de Boyle, que resume estas observaciones, establece que: el volumen de una determinada cantidad de gas, que se mantiene a temperatura constante, es inversamente proporcional a la presión que ejerce, lo que se resume en la siguiente expresión:
P.V = constante o P = 1 / V
y se pueden representar gráficamente como:

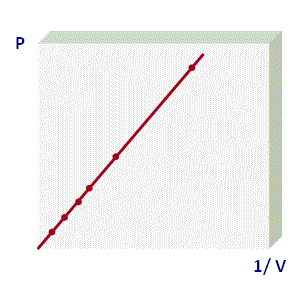
La forma que más utilizamos para representar la Ley de Boyle corresponde a la primera gráfica, donde se muestra a un rama de una hipérbola equilátera y podemos usar la siguiente expresión para determinar los valores de dos puntos de la gráfica:
P1 . V1 = P2 . V2
Este tipo de gráficos se denominan isotermas, por lo que a los procesos que cumplen con la Ley de Boyle se les denomina procesos isotérmicos. Para visualizar un video que muestra un experimento de la ley de Boyle, haz click aquí.
 | Recuerda Para que para que se cumpla la Ley de Boyle es importante que permanezcan constantes el número de moles del gas, n, y la temperatura de trabajo, T. |
Ley de Charles
Cuando se calienta el aire contenido en los globos aerostáticos éstos se elevan, porque el gas se expande. El aire caliente que está dentro del globo es menos denso que el aire frío del entorno, a la misma presión, la diferencia de densidad hace que el globo ascienda. Similarmente, si un globo se enfría, éste se encoge, reduce su volumen. La relación entre la temperatura y el volumen fue enunciada por el científico francés J. Charles (1746 - 1823), utilizando muchos de los experimentos realizados por J. Gay Lussac (1778 - 1823).
La ley de Charles y Gay Lussac se resume en: el volumen de una determinada cantidad de gas que se mantiene a presión constante, es directamente proporcional a su temperatura absoluta, que se expresa como:

Debemos tener presente que la temperatura se DEBE expresar en grados Kelvin, K. Para determinar los valores entre dos puntos cualesquiera de la recta podemos usar:
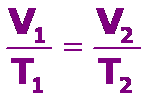
Los procesos que se realizan a presión constante se denominan procesos isobáricos.
Análogamente, la presión de una determinada cantidad de gas que se mantiene a volumen constante, es directamente proporcional a su temperatura absoluta, que se expresa como:

Los procesos que se producen a volumen constante se denominan procesos isocóricos. Para determinar los valores entre dos estados podemos usar:
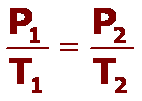







No hay comentarios:
Publicar un comentario